2006 年底,美國霍華德‐休斯研究所的華裔科學家莊曉薇實驗組開發出來一種類似於 PALM 的方法,可以用來研究細胞內源蛋白的超分辨率定位。他們發現,不同的波長可以控製化學熒光分子 Cy5 在熒光激發態和暗態之間切換,例如紅色 561nm 的激光可以激活 Cy5 發射熒光,同時長時間照射可以將 Cy5 分子轉換成暗態不發光。之後,用綠色的 488nm 激光照射 Cy5 分子時,可以將其從暗態轉換成熒光態,而此過程的長短依賴於D二個熒光分子 Cy3 與 Cy5 之間的距離。因此,當 Cy3 和 Cy5 交聯成分子對時,具備了特定的激發光轉換熒光分子發射波長的特性。將 Cy3 和 Cy5 分子對膠聯到特異的蛋白質抗體上,就可以用抗體來標記細胞的內源蛋白。應用特定波長的激光來激活探針,然後應用另一個波長激光來觀察、精確定位以及漂白熒光分子,此過程循環上百次後就可以得到*後的內源蛋白的高分辨率影像,被他們命名為隨機光學重構顯微技術 (stochastic optical reconstruction microscopy,STORM)。2007 年,他們進一步改進 STORM 技術,發展了不同顏色的變色熒光分子對,可以同時記錄兩種甚至多種蛋白質的空間相對定位,從而闡明籠形蛋白 clathrin 形成的內吞小泡與細胞骨架蛋白之間的精確空間位置關係,兩種顏色的分辨率都可以達到 20~30nm。原理如下圖:
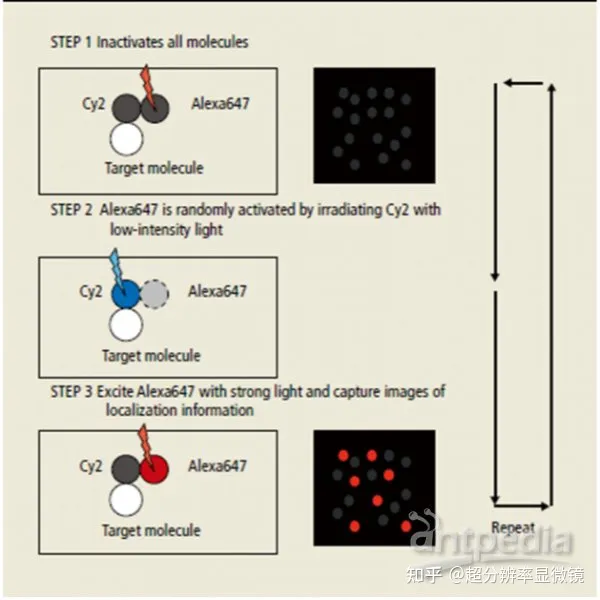
STORM 通過一對染料對通過隨機發光空間定位,實現了 XY 20 nm 分 辨率。
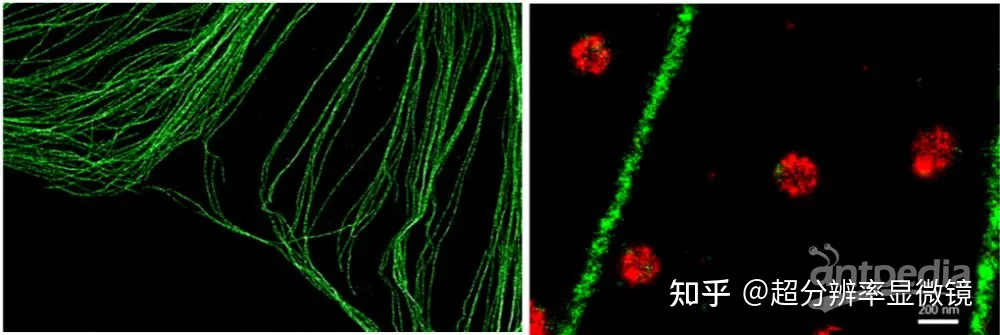
SIM
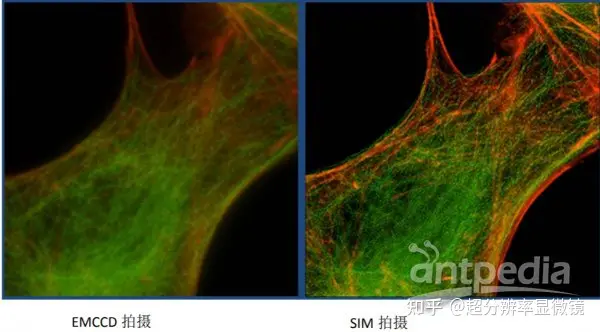
改變光學的點擴散函數來突破光學J限的另一個方法是利用飽和結構照明顯微技術(saturated structure illumination microscopy,SSIM)。早在 1963 年,Lukosz 和 Marchand 就提出了特定模式側向入射的光線可以用來增強顯微鏡分辨率的理論。2005 年,加州大學舊金山分校的 Gustafsson 博士首先將非線性結構性光學照明部件引入到傳統的顯微鏡上,得到了分辨率達到 50nm 的圖像。SSIM 技術的原理是將多重相互衍射的光束照射到樣本上,然後從收集到的發射光模式中提取高分辨率的信息。如圖所示:

SIM 通過結構照明莫爾紋原理實現了任何熒光染料都可以達到 XY 100nm。
文章來源於網絡,如果有侵權,請聯係bsports官网登录刪除,謝謝~