來源:小小光08
1引言根據阿貝定律,當一個點光源經過一個完善的光學係統後,由於光的衍射效應,z終仍然形成的是一個模糊的光斑像(艾裏斑),光斑的半峰全寬滿足FWHM≈0.61λ/NA,其中λ為該光學係統的工作波長,NA為該光學係統的數值孔徑。上式也是一個點擴展函數(PSF)的半高全寬的描述。它說明:如果一次把處於這個半徑裏麵的粒子亮起來,那用光學顯微是無法分辨它們的。所以,這個公式也就是光學顯微分辨率的描述。一個光學成像係統的分辨率取決於兩個點光源像之間的z小距離,如果要提高成像分辨率,則需減小其工作波長或提高係統的數值孔徑(通常采用高數值孔徑的物鏡)。對於常見的工作在可見光波段的光學顯微鏡,其分辨率J約為200nm。那麽如何在現有的情況下進一步提高係統的成像分辨率,從而突破衍射J限限製的分辨率成像呢?隨著科研人員的不斷探索,通過多種不同的光學係統設計,小於100nm的分辨率得以實現。這些可以突破衍射J限成像的高分辨率光學顯微技術,稱為超分辨成像技術。根據其原理的不同,現有的超分辨成像技術可以分為兩大類:一類是基於單分子定位成像的方法,利用特殊熒光分子的光開關特性或者其他機製在不同時刻隨機激發稀疏的熒光點,通過相應算法對熒光分子進行定位;另一類是改造成像係統的點擴散函數,進而實現突破衍射J限分辨率的成像。2 基於單分子定位的超分辨成像第Y類方法基於分子定位實現的超分辨成像,主要包括光激活定位顯微技術(Photoactivated localization microscopy, PALM)和隨機光學重構顯微技術(Stochas-tic optical reconstruction microscopy, STORM)。具有光開關特性的熒光蛋白是這類技術的關鍵。2002年,Patterson等頭次發現了一種熒光蛋白PA-GFP,它在未激活狀態下不發光,用405nm的激光激活一段時間後,才能被488nm激發光激發,發出綠色熒光信號。2006年,Betzig 等利用這種具有開關特性的熒光蛋白結合單分子熒光成像技術,頭次提出了PALM。
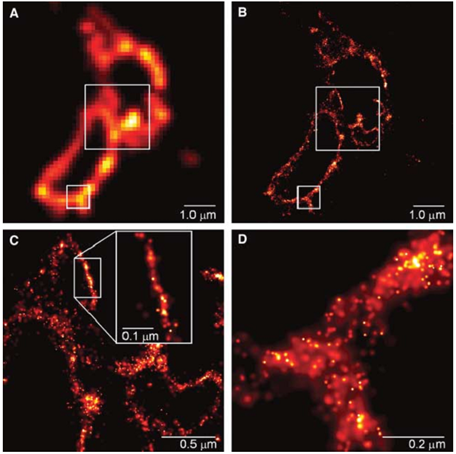
圖1:PALM用於觀察溶酶體跨膜蛋白同年,莊小威等利用熒光蛋白Cy5在不同激發波長下表現出的開關特性,提出了“隨機光學重構顯微技術 (STORM) ”。
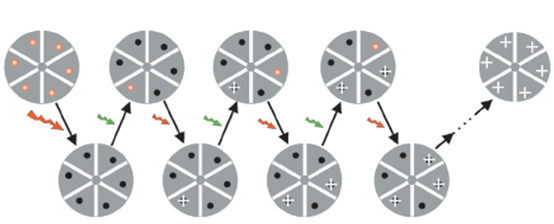
圖2:STORM技術原理當兩個發光團太接近的時候,傳統顯微鏡不能分辨。莊小威的想法就是,如果能夠用兩種顏色的光,一束通過光漂白,讓大部分粒子激發過度到達暗態;另一束通過激活,讓J個別暗態的粒子再激活過來。由於激活的是J少數。這樣,就有一部分粒子是隻有自己發光、周邊都是不發光的,就可以很容易地把它定位出來;把它激發、漂白,再激發另外的一些粒子,如此往複。而且,她發現了一個重要的Cy3-Cy5對,發不同顏色的光,這一對熒光團過去被用在熒光共振能量轉移FRET成像研究中。莊小威在進行感冒病毒的研究中偶然發現,這一對可愛的蛋白能夠像開關一樣,通過光控製它們或者發熒光,或者不發熒光。PALM與STORM的原理大致相同,都是利用反複激活-漂白熒光分子,從而獲得稀疏的熒光分子的位置信息,經過上百次的循環迭代,將得到的細胞內所有熒光分子的精確定位重構到同一張圖像上,z後可以獲得分辨率比傳統光學顯微鏡至少高10倍的顯微圖像。不同的是,STORM可以用來研究細胞內源蛋白的超分辨定位。然而,從PALM和STORM的基本原理中可以發現,這兩類超分辨成像技術所依賴的還是傳統的光學顯微係統,其光學點擴散函數並沒有發生改變,即單次成像分辨率依然處於衍射J限內,它是“用時間換空間”,通過犧牲時間分辨率來獲得高的空間分辨率。3基於點擴散函數改造的超分辨成像這類方法通過改造光源來壓縮光學係統的點擴散函數(PSF),實現超分辨成像,這類成像手段主要包括受激發射損耗(Stimulated emission depletion, STED)顯微技術,結構光照明顯微技術(structured illumination microscopy, SIM),可逆飽和線性熒光躍遷(reversible saturable optical linear fluorescence transitions)顯微技術等。STED顯微技術z早於1994年,由Stefan W. Hell等提出,通過受激發射損耗的方式來改變熒光基團發射熒光的點擴散函數。一些熒光分子在激發光照明下處於激發態,但當用另一束比激發光波長更長的激光照射時,熒光分子可以從激發態猝滅回到基態,即在兩束激光同時照射時發光。基於這樣一種熒光特性,Hell等用一束激光照射樣品的同時,用另一束高能脈衝激光形成緊挨的環形激光照明,波長比激發光稍長,這樣被短波激發的熒光大部分通過受激發射損耗的過程猝滅,壓縮了點擴散函數,提高了顯微鏡的分辨率。然而STED的成像需要對樣品進行點掃描,並且所采用的激光光強過大,可能導致觀測樣品的光漂白甚至光毒性。同時STED成像的光路複雜,係統搭建成本也較高。
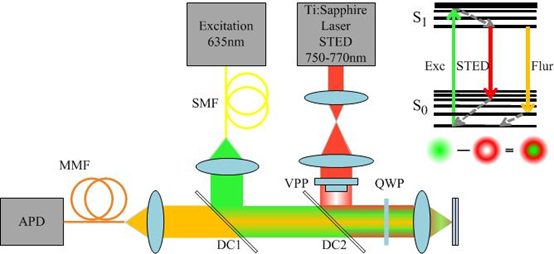
圖3:典型的STED係統結構示意圖圖3中,綠箭頭代表粒子被激發從低能級S0到高能級S1,然後粒子會弛豫到亞穩態---高能級的z低點。接下來粒子會在這裏停留很短的時間(短到幾個ns),然後粒子再回到低能級S0。這是絕大多數電子的選擇。跳下來的時候它們會降落在S0能級的不同高處,並形成一定的分布。還是在圖3中,如果綠色箭頭引發的熒光現象的z小PSF是綠色的圓圈半徑,這時候如果給它套上一個紅色橡皮擦(粒子做受激輻射波長相同),那剩下的就是為數不多、居於中間的熒光了,這樣就縮小了點擴展函數,實現了超分辨。在實驗操作上,選一種合適的熒光物質,按順序先給激發脈衝(2ps左右),等它躍遷上去了馬上給一個受激輻射波長的脈衝(250ps左右),然後用二向色鏡區分受激輻射跟自發輻射,探測過來的自發輻射信號。受激輻射越大(橡皮擦得幹淨),剩下的PSF越小,也就是分辨率越高。這個就是Pulsed STED.也可以給連續信號,因為二向色鏡都能區分,隻不過擦得沒那麽幹淨了,這個就是CW STED。不同於STED需要經過逐點掃描成像,SIM是一種寬場顯微成像技術,可以獲得更高的成像速度,更適合活體、低漂白的生物研究。SIM利用非均勻的正弦條紋照明光照明樣品,當被測樣品精細形貌與條紋狀照明光相互疊加時,可以獲得一個比兩者空間頻率都低的“莫爾條紋”。而這個莫爾條紋中同時帶有樣品和照明光的信息,換句話說,利用結構光照明可以將無法被光學係統采集的高頻樣品信息編碼形成空間頻率相對較低、可以被收集的莫爾條紋信號。利用後期圖像重構技術,樣品的高頻信息可以重現在所獲得的圖像上,從而實現了突破衍射J限的超分辨成像。同時利用多束光幹涉的辦法,可以將二維結構光照明成像擴展到三維成像領域。目前已經實現橫向100nm,軸向200nm左右的分辨率。雖然 SIM的分辨率低於其他超分辨成像技術,但其方法簡單,不需要特殊的熒光標記,同時可以實現快速、動態、三維的超分辨成像。
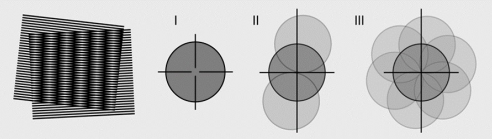
圖4:超分辨SIM的物理原理基於莫爾條紋和頻譜擴展共聚焦通過一個點照明,加一個針孔實現分辨率提升。準確地說,由於在分辨率上,光噪聲總是帶來幹擾,所以用一個針孔把光噪聲去除,就能夠將分辨率提升。共聚焦可以提升1.4倍分辨率,因為即使針孔小到隻有一個點,根據光路可逆原理,這個點到了樣品上也有點擴展函數那麽大,z終,共聚焦的點擴展函數就是激發光的點擴展乘以針孔點擴展。共聚焦通過阻擋接收實現分辨率提升,而SIM則是通過給照明光一個調製實現分辨率提升。如果將SIM的結構調製通過共軛放在接收端,則SIM也是一個一維調製。進一步,通過從多個角度進行一維限製,可以z終得到二維的分辨率提升。目前,比較流行的是每隔120度進行一次,SIM可以提升2倍的分辨率。
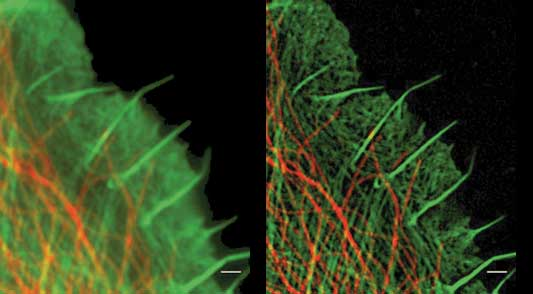
圖5:SIM超分辨成像(右)總的來說,由於光學衍射效應所帶來的成像分辨率的限製,通過單分子定位和改造光學係統點擴散函數的方式,犧牲一定時間分辨率來獲得突破衍射J限的成像,是目前的主流方法。除上述所提到的依據熒光成像原理的遠場超分辨成像技術外,采用近場掃描光學顯微技術(NSOM)也可以獲得突破衍射J限的成像。近場光學成像不同於經典光學,其探針距樣品僅波長量級的長度,可以收集遠場成像所收集不到的近場信息,進而獲得與原子力顯微鏡相當的成像分辨率。4 國內對超分辨成像技術的研究進展目前國內對超分辨成像技術已經展開了廣泛而深入的研究。
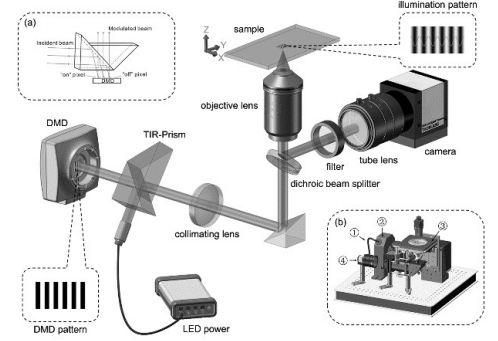
圖6:DMD-SIM實驗光路圖中國科學院西安光學精密機械研究所采用數字微鏡器件(DMD)和LED照明的結構光照明方案,減少了散斑幹涉等不利因素造成的背景噪聲,能夠獲得90nm的空間分辨率以及190ms的切片速度。
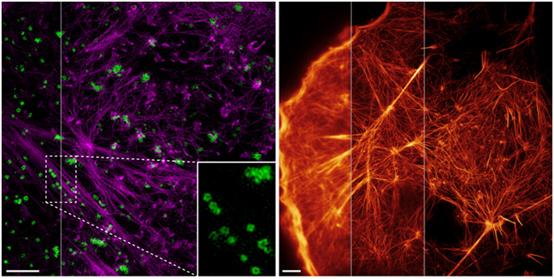
圖7:兩種方法提高活細胞顯微成像的分辨率。左圖:雙色高數值孔徑物鏡的全內反射結構光顯微成像技術(highNA TIRF-SIM)。紫色:激動蛋白(actin);綠色:內吞小泡(CCP)。右圖:基於非線性激活Skylan-NS標記的激動蛋白的非線性結構光照明(PA NL-SIM)成像。2015年,中國科學院生物物理研究所與美國霍華德·休斯醫學研究所等單位的科學家在《科學》上發表利用一種新型反複激活熒光蛋白Skylan-NS和結構光激活非線性SIM技術,獲得了在細胞運動和改變形狀的過程中骨架蛋白的解體和自組裝過程,以及在細胞膜表麵稱為“caveolae”的微小內吞體動態過程的影像,其分辨率能達到62nm。
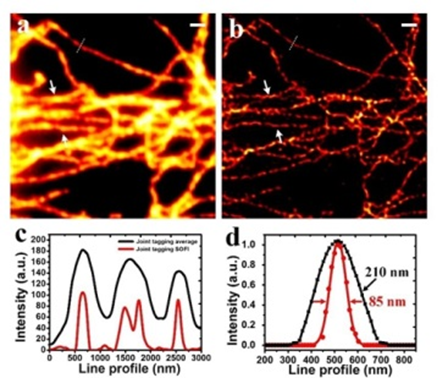
圖8:寬場成像和超分辨JT-SOFI成像的比較(Scale bar:1um)2015年,北京大學席鵬結合了量子點、光譜方法和SOFI超分辨技術,在普通寬場顯微鏡上,實現了3s獲得85nm的超高時空分辨率的成像,使用不同發射波長的量子點的聯合標記,有效減少了高階成像的偽影,更加真實地還原出生物樣品的完整結構和細節信息。
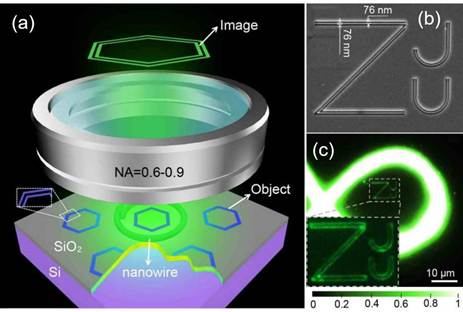
圖9: 納米線環形照明顯微術機理示意圖(a)及“ZJU”結構觀察效果圖(b)
2017年,浙江大學楊青、劉旭將納米線作為局域光源,提出了一種稱為“納米線環形照明顯微術”(Nanowire ring illumination microscopy, NWRIM)的技術,頭次實現了大視場、無標記的超分辨成像,其視場目前達數千平方微米,比以往報道的無標記型遠場超分辨顯微方法擴展了1個數量級以上。
原文章鏈接://mp.weixin.qq.com/s?__biz=MzU1NjU1MDk2Mw==&mid=2247490258&idx=1&sn=e240516605bf0254eae9cf2dc85199d8&chksm=fbc2048eccb58d98b079a105165776609cbd7a081f6bca949788a91edf7914bfbe0327f9f3f2&mpshare=1&scene=1&srcid=07160hyPSAac9iM2HXknkZCU&sharer_sharetime=1689496833891&sharer_shareid=e1017a55dd0f8d4278d30e79fd2b0947#rd